Denne artikkelen er levert av Titan.uio.no, en nettavis utgitt av Universitetet i Oslo (UiO).
Kan en datamaskin forutsi sykdom og gi råd om akkurat hvilken behandling som er best for deg?
En rekke sykdommer har komplekse biologiske årsaker som er vanskelige å forstå uten bruk av omfattende digitale hjelpemidler. Leger og forskere trenger hjelp fra en digital doktor.
– Vi jobber med å utvikle digitale modeller for å stille en mest mulig presis diagnose og utvikle bedre behandling, sier førsteamanuensis Marianne Fyhn ved Institutt for biovitenskap ved Universitetet i Oslo.
Kreft og Parkinsons sykdom
Hjerneforskeren snakker om schizofreni, men det samme prinsippet ligger også til grunn for store forskningsprosjekter rettet mot kreft og Parkinsons sykdom.
Først må forskerne samle omfattende mengder data fra et biologisk system. Med grunnlag i dataene utvikler de komplekse matematiske modeller som beskriver sammenhenger i systemet. Dersom modellene er gode og representerer virkeligheten, bør de kunne forutsi hvordan systemet endrer seg når noe skjer.
Forskerne kan så gjøre eksperimenter for å teste om de virtuelle beregningene samsvarer med den virkelige verden.
DigiBrain
Fyhn og kollegaene hennes i prosjektet DigiBrain tar utgangspunkt i en verdensomspennende analyse av prøver fra nesten 100 000 schizofreni-pasienter og like mange kontrollpersoner. Resultatene viser at 120-150 genvarianter er hyppigere til stede hos pasientene sammenlignet med normalbefolkningen.
– Vi vil finne ut hva disse genene betyr for kommunikasjon mellom hjernecellene og hvordan forandringer i hjerneaktiviteten henger sammen med sykdommen.


Et av forskningsverktøyene de bruker, er å måle hjerneaktiviteten fra utsiden av hjernen ved hjelp av elektroder montert på en hette. Metoden kalles elektroencefalografi, forkortet EEG.
Kartlegger hjerneaktivitet
Postdoktor og deltager i prosjektet Torbjørn Elvsåshagen forklarer at EEG-målinger som oftest brukes for å undersøke pasienter med epilepsi. Teknikken bidrar også til forskningsarbeidet for å kartlegge hjerneaktiviteten hos pasienter med schizofreni og bipolar lidelse.
– Vi bruker EEG i forskning for å avdekke sykdomsmekanismer. Vi kjenner ikke detaljene for hva som er annerledes i hjernen til personer med schizofreni og bipolar lidelse, og mange opplever at medisinene de får, ikke fungerer, sier han.
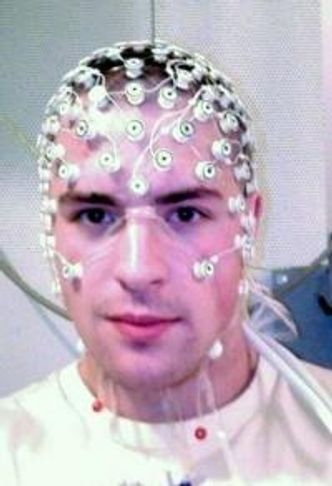
På klinikken på Ullevål sykehus bruker Elvsåshagen EEG for å utføre en test kalt «pre-pulse inhibition».
Hjernen reagerer ikke
– Alle dyr reagerer instinktiv med å skvette dersom de hører en høy lyd. På laboratoriet kan vi måle responsen ved hjelp av EEG og sensorer som registrerer muskelsammentrekninger omkring øynene, forklarer Elvsåshagen.


Reaksjonen på den høye lyden blir som oftest mindre dersom personen først får høre en lav lyd. Forvarselet gjør at hjernen ikke reagerer like mye på den etterfølgende høye lyden.
Ved å sammenligne store grupper av friske personer med personer med schizofreni, ser forskerne imidlertid at personer med schizofreni ikke reagerer på samme måte. De er i større grad upåvirket av forvarselet og skvetter mer enn mennesker uten schizofreni.
EEG gir sammensatt bilde
– Vi vil også undersøke hvordan genvariantene knyttet til schizofreni og bipolar lidelse påvirker kommunikasjon mellom nerveceller i hjernen ved bruk av EEG og datamodeller, sier han.
EEG gir et sammensatt bilde av hjerneaktivitet, men for å komme helt til bunns i hvordan hjernen fungerer hos friske og syke personer, trenger forskerne også å studere selve hjernevevet.
Ved Universitetet i Bergen (UiB) forsker gruppeleder Charalampos Tzoulis på hjernevev fra pasienter med Parkinsons sykdom. Til nå har han og kollegaene hans analysert vev fra totalt hundre hjerner fra friske og syke personer som har testamentert kroppene sine til forskning.
Digitaliserer hjernen
– Vi prøver å «digitalisere» hjernen for å finne ut hva som er årsaken til Parkinsons sykdom, sier Tzoulis om prosjektet ParkOme.
Analysene er dyre og omfattende,og gir en komplett oversikt over DNA'et, de epigenetiske markørene som styrer hvordan genene blir brukt, samt detaljerte analyser av både RNA og proteiner.
– Vi setter sammen all informasjonen i en database og bruker algoritmer og maskinlæring for å prøve å forstå hvordan nettverket henger sammen. Vi håper å finne ut hvordan hjernevev hos syke personer skiller seg fra friske personer, forklarer Tzoulis.
NeoAva
Informasjonen om hjernevevet kan også settes sammen med andre typer data for å gi nye innsikter. De norske helseregistrene representerer unike muligheter for forskere som Tzoulis.
– Vi har brukt reseptregisteret til å oppdage at en medisin mot diabetes reduserer risikoen for Parkinsons sykdom, forklarer forskeren, som snart skal starte en ny klinisk studie basert på hypoteser fra de digitale modellene.
Kliniske studier for å teste nye legemidler kan også ha verdi lenge etter at forsøkene er avsluttet. Ved UiO bruker matematiker Alvaro Köhn-Luque data fra en studie om behandling av brystkreft (NeoAva) for å bygge digitale modeller.
BigInsight og PERCATHE
I prosjektene BigInsight og PERCATHE, ledet av professor Arnoldo Frigessi ved Oslo Universitetssykehus, er målet å lage avanserte matematiske modeller som kan bidra til å velge rett behandling for kreftpasienter.
– Vi lager virtuelle kopier av en liten del av en kreftsvulst og inkluderer så mye data som mulig om pasienten og kreftsvulsten. Så tester vi å gi samme behandling i datamodellen som pasienten fikk i studien, forklarer Köhn-Luque.
Først tester han om den digitale datamodellen oppfører seg likt med hvordan det gikk med pasienten. Deretter gir han algoritmene frihet til å teste en hel rekke andre behandlingsformer som kunne ha gitt et bedre resultat mot den virtuelle kreftsvulsten.
1 000 celler fra svulst
Modellene er basert på et lite utsnitt med 1000 celler fra en kreftsvulst. En hel svulst inneholder hundrevis av millioner av celler, både friske celler og ulike grupper av kreftceller.
Det er et godt stykke igjen før de digitale modellene tilsvarer en virtuell pasient.
– Modellene er en stor forenkling av virkeligheten. Funnene våre gir teorier og kunnskap som vi håper kan brukes i klinikken i fremtiden, sier Köhn-Luque.
Ved Haukeland Universitetssykehus har professor Bjørn Tore Gjertsen tatt i bruk detaljert informasjon om kreftcellene for å vurdere behandlingsvalg for pasientene. Gjertsen leder et av forskningsprosjektene i CCBIO, et senter for fremragende forskning ved UiB.
Rammer cellene i blodet

Pasientene har kreftsykdommer som rammer celler i blodet. Blodsykdommer er svært heterogene, med mange undergrupper. For de fleste mangler det målrettede legemidler.
– Selv om standardbehandling ofte kan bremse sykdommen, vet vi ikke hva som skjer med sykdommen under behandling, forklarer Gjertsen.
Han tester derfor om en ny enkeltcelle-analyse kalt masse-cytometri, sammen med en ny medisin som blokkerer proteinet AXL, kan bedre prognosene for noen av pasientene.
– Vi har trolig gode biomarkører for hvem som vil respondere på AXL-inhibitoren og bruker nå komplekse molekylære data for å forutsi hvem som kan ha best nytte av å prøve den nye medisinen, sier Gjertsen.
Fulgt 15 pasienter
I en klinisk studie har de fulgt 15 pasienter over tid og testet dosering og toleranse av legemidlet. Gjertsen har samlet data om genmutasjoner i kreftcellene, respons på behandling og detaljert informasjon om celler i blod og beinmarg. Siden disse dataene følges over tid, blir kompleksiteten stor.
Jevnlige blodprøver gjør det mulig å følge med på utviklingen, og Gjertsen er avhengig av et tett samarbeid med matematikere, statistikere og bioinformatikere for å analysere og visualisere de komplekse dataene.
Resultatene er svært verdifulle.
Komplekse datasett
– Vi har vi mye data som vi gjerne skulle ha tatt i bruk i klinikken, fordi vi tror at det langt raskere viser hvem som svarer på behandlingen. Vi vil i langt mindre grad behandle pasienten i blinde, og dette vil hjelpe til med å gi bedre behandling til pasientene.
– Vi ønsker å bruke komplekse analyser til å oppdage forandringer i kreftcellene som tilsier at vi bør justere behandlingen underveis, sier Gjertsen.
Komplekse datasett kan gi bedre behandling, og modellene er også en gullgruve for eksperimenter som tar sikte på å avdekke ny kunnskap om hva som har gått galt i en kreftsvulst og hos pasienter med Parkinsons sykdom eller schizofreni.
Genetiske forandringer
I Forskningsparken i Oslo arbeider førsteamanuensis Camila Esguerra med å undersøke konsekvensene av genetiske forandringer i hjerneceller hos fisk.
Esguerra er en av partnerne i prosjektet DigiBrain, der hun samarbeider med Fyhn og Elvsåshagen for å forstå årsaker og finne nye behandlingsmuligheter for pasienter med schizofreni.
– Det overordnede målet med prosjektet er å undersøke hvordan genetiske forandringer endrer hvordan hjernecellene kommuniserer med hverandre, sier hun.
(artikkelen fortsetter under)

Bygger datamodeller
Esguerra forsker på fisk som har defekter i ett av de samme genene som også er forandret hos schizofrenipasienter. Hun bruker den samme «pre-pulse inhibition»-undersøkelsen på fiskene som Elvsåshagen bruker på pasientene sine.
– Fiskene våre er ingen erstatning for forsøk med mus eller data fra mennesker. Det er kombinasjonen av modeller som utgjør styrken i prosjektet og som gir oss en bedre forståelse, sier hun.
I prosjektet utvikler forskerne også datamodeller av hjerneceller med de samme forandringene, og ved Institutt for biovitenskap tester Marianne Fyhn «pre-pulse inhibition» på mus i laboratoriet.
– Endrer aktivitet
– Ved å endre aktiviteten til hjernecellene, viser vi at musene skvetter mer. Nå skal vi benytte oss av genredigeringsverktøyet CRISPR for å etterligne de humane genforandringene og undersøke effekten på hjernecellene i detalj, sier hun.
Samarbeidet gir viktig synergi mellom fagfeltene, og samspillet mellom digitale og ulike eksperimentelle resultater bidrar til bedre diagnose og bedre behandling.
Nå starter arbeidet med å teste nye legemidler både i virtuelle hjerneceller og i laboratoriene.
Høye ambisjoner
For at de overnevnte helseprosjektene skal bli en suksess, avhenger de av et tett samarbeid mellom svært ulike faggrupper. Sammen skal de bidra til å gi best mulig digital forståelse av komplekse, biologiske fenomener. Det krever tålmodighet og samarbeidsvilje.
Felles for de store helseprosjektene er at de har høye ambisjoner for hvordan de digitale modellene skal bidra til å øke kunnskap om sykdom og til å redde liv. Satsingene er omfattende og langsiktige.
– Forskningen går langt utover akkurat det ene prosjektet. Det er bare begynnelsen, sier Esguerra.
Artikkeleforfatteren er kommunikasjonsrådgiver i Digitalt Liv Norge